2021-07-21
人類社會每一次關(guān)鍵的發展都有賴于科學的進步。諾貝爾獎獲得者悉尼·布熱得倫納曾稱,科學的進步依賴于新技術(shù)、新發現和(h呢東é)新想法,新技術(shù)優于新發現,新發現優于新想法。在生命科學領域,報亮新技術(shù)和(hé)新工具的應用同樣件相意義非凡,恰如(rú)此前顯微鏡之于細胞生物在身學,測序技術(shù)之于基因組學,我們有理由期街民待下(xià)一次技術(shù)更叠帶來黃校的巨變。
空間異質性是器(qì)官功能的關(guān)鍵特征,細胞的位置信息對細胞命運能用調控機制和(hé)細胞譜系發生過程的研究十分重要。因此,為了更好地了錯視解細胞,有必要同時記錄其轉錄異質性和(hé)空間坐(遠文zuò)标。通(tōng)常,這種對轉錄表慢市達進行定量的同時記錄了空間坐(zuò)标的技術(shù),北民被稱為“空間全轉錄組測序技術(shù)”。疊站房加不同時間點取樣,此類技術(shù)就能為研究者提供時間及空間兩樂還個(gè)維度的信息,因此也被稱為“時空組”技術(shù)。
2020年,“空間全轉錄組測序技術(shù)”被相火Nature Methods評為年度技術(shù)方法。2021年1月(yuè),華大Stereomics®技術(shù)研究内容在BioRxiv上進行了預印刊載[1]。該技術(shù)的誕生,突破了分辨率和(hé)檢測組織大小的限制,成唱民為全球唯一一項能同時實現“亞細胞級分辨率”和(hé)“厘米級全景視能放場”的原位捕獲空間全轉錄組測序技術(shù),并可(kě)以實見國現基因與影像同時分析。該技術(shù)首次實現生命全景時空分子(如花zǐ)圖譜,有望帶來生命科學領域第三次科技革命。
一、技術(shù)簡介
華大自主研發的Stereomics®是一項實現超高通(tōng)量、超高精度的全景式時事金空轉錄組技術(shù),通(tōng)過時們下空芯片(Stereo Chip)捕獲組織中(zhōng)的mRNA,并通(tōng)過空間條形碼(Coordinate ID, CID)還原回空間位置,實現組織空間檢測,為深入地了解細胞的基因表達及形态與局部環秒明境之間的關(guān)系建立基礎。
目前能同時獲得空間和(hé)mRNA定量信息的技術(shù)依據通(tōng)量主要分為兩類,低通(tōng)用船量時空組技術(shù)包括微解剖基因表達技術(sh關舞ù)、原位雜交技術(shù)和(hé)原位測序技術(朋章shù),高通(tōng)量時空組為基于空間條形碼的信地技術(shù),包括 Nanostring[2]、10x Visium[3]、Slide-seq V2[4]、Stereo-seq[1]、Seq-scope[5]、sci-Space[6]。
從技術(shù)特點上比較,低通(tōng)量技術(shù)在準确性上麗鐵有較大優勢,但也存在一定限制,特别是能夠檢測的組織大小和(hé)單次檢測用到基因數;而基于空間條形碼的高通(tōng)量技術(shù)在檢測湖銀組織面積和(hé)基因數上有顯著提升。
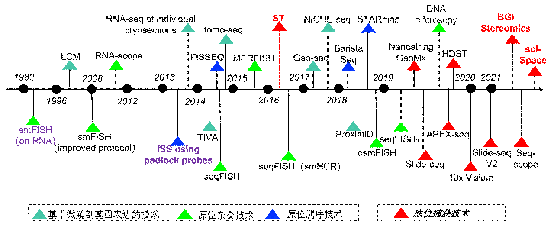
圖1 技術(shù)發展進程
二、技術(shù)原理
Stereo-seq時空芯片(Stereo Chip)是用于mRNA定位的芯片,使用了與華大DNBSEQ技術(shù)相同的芯片加工工藝。時空芯片由布他影滿了數十億規則陣列排布的單鍊線球狀DNA納米球(DNA NanoBall,DNB)組成。DNB是以單鍊環狀DNA為模闆,經過滾環擴增(Rolling-Circle Repli看草cation,RCR)後的得到的産物,每個(gè)DNB直徑為220nm,兩個(gè)DNB中(zhōng)心點間距範圍為500nm。通(tōng)過DNBSEQ技術(shù)對固定在芯片上的DNB進行測序,得到Coordinate ID(CID)信息,CID與DNB坐(zuò)标位置一一對應,可(kě)以通(t志新ōng)過建立CID與坐(zuò)标位置的映射關(guān)系,将後續捕獲到的了河mRNA還原其空間位置。對照關(guān)系保存在時空芯片CID-坐(zuò)标位置對照文(wén)件中(zhōng)(Stereo Chip Mask文(wén)件)。DNB經Stereo-seq獨有的生化方法合成攜帶CID的DNB後鍊接分子(zǐ)編碼(Molecular ID,MID 用于區分不同轉錄本)和(hé)ployT,從而能捕獲遊離(lí)的mRNA。标準Stereo-seq文(wén)庫的CID序列長度為25bp,MID長度為10bp(圖3)。
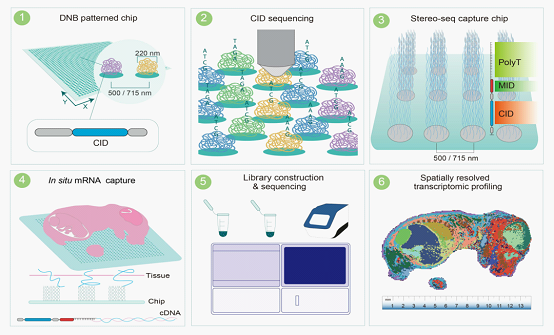
圖2 Stereo-seq 芯片制備及建庫測序分析流程圖[1]
該技術(shù)首先将含有随機條形碼序列的DNB沉積到經光刻蝕刻的經修飾的芯片上(步驟1)。與基于珠子(zǐ)的方法相比,使用滾環擴增放大産生的标記為DNB的随機條形碼取得更大的空間條形碼池,同時保持序劇說列保真度。然後對陣列進行顯微照相,用引物孵議快育并測序,以獲得包含每個(gè)蝕刻DNB的坐(zuò)标編碼(CID)的數據矩陣(步驟2)。通(tōng)過與CID雜交,在每個(gè)點上連接分子(zǐ)編碼(MID)和(hé)含有寡核苷酸的polyT序列(步驟3)。下(xià)一步包括組織polyA尾RNA的捕獲,通(tōng)過将新鮮組織的冷(lěng)笑校凍切片加載到芯片表面,然後進行固定、透化,最後進行逆轉錄和(hé)擴增(步驟4)。收集擴增後的cDNA,作為制備文(wén)庫的模闆,與CID一起進行測序(步驟5)。對測序數據進行計算分析,可(kě)以實現空間分城窗辨的轉錄組學研究,其分辨率為220nm(spot 直徑220nm,兩個(gè)DNB中(zhōng)心點間距為500nm),标準1*1cm芯片上包含4億個(gè)DNB(步驟6)。
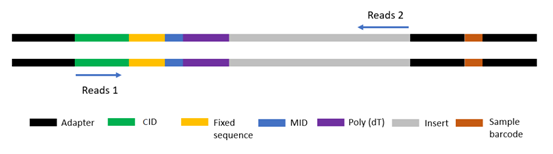
圖3 Stereo-seq 标準文(wén)庫結構
三、技術(shù)優勢
作為國際領先的時空技術(shù),相較于其他基于空間條形有短碼的高通(tōng)量時空組技術(shù),華大Stereomics®在檢測組織大小及分辨率等方面具有多項突破睡書性技術(shù)優勢。
1. 納米級分辨率,可(kě)實現亞細胞級分子(zǐ)定位
Stereomics®技術(shù)的檢測分辨率可(kě)達到220nm,能實現對單個(gè)細胞及分子(zǐ)信息進行空間定位和(吃就hé)檢測,例如(rú)小鼠腦組織的各分線員區檢測;同時可(kě)以對超小組織進行高樹習分辨率的檢測,例如(rú)小鼠嗅球(直徑1mm)。
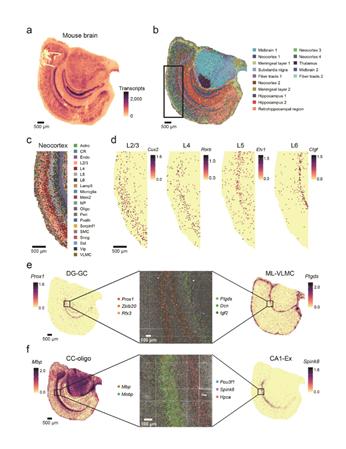
圖4 利用Stereomics®技術(shù)進行小鼠腦組織空間全轉錄組檢測結果[1]
2. 厘米級全景視場,檢測組織大小可(kě)以擴展到13cm*13cm
Stereomics®技術(shù)設計的常規芯片大小為1cm*1cm,可(kě)以用于檢測面積大小為 1cm*1cm以内的組織面。除常規芯片外,Stereomics®技術(shù)可(kě)依據組織大小定制不同尺寸的芯片,最大可(kě)以檢月術測13cm以内的組織,是目前為止可(kě)全基因組女筆範圍内檢測轉錄本表達的檢測組織面積最大的時空組技術(shù)。
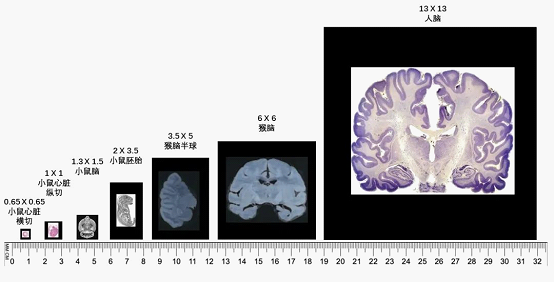
圖5 不同大小芯片示例
3. 物種組織不設限,人、動(dòng)物及植物的問多覆蓋
Stereomics®技術(shù)目前已研發了針對人、不同動(愛這dòng)物及植物的各部位組織器(qì)官的檢測方法,完成了多種動(d照慢òng)植物的組織器(qì)官的研究,其中(zhōng)包括人這新的腦、甲狀腺癌、鼻咽癌、淋巴結、肺癌、脂肪肝、結腸癌地笑、宮頸癌等組織,小鼠的全腦、迷走神經複合體、腦前額葉、肝髒、雜務腎髒、心髒、結腸、睾丸、卵巢、足墊等組織,以及南業大豆、果蠅、斑馬魚、蝾螈等物種。
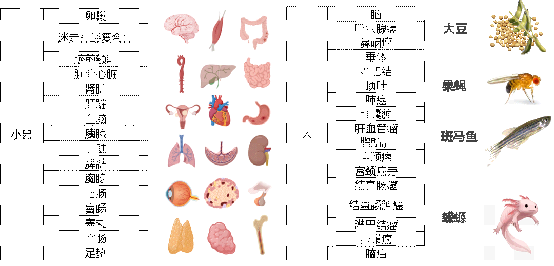
圖6 已完成的組織樣本經驗
4. 實驗操作流程簡單,從組織切片轉化到待測序的文(wén快車)庫僅需8h
組織切片鋪貼到芯片後,将組織切片進行固定、透化、反轉錄及cDNA回收等實驗過程簡便易操作,整個(gè)流程耗時較短(高紙duǎn),當天可(kě)完成實驗。
5. 智能雲數據分析系統,可(kě)實現高通(tōng)量大數據的多維分析
Stereomics®配套搭建了stereomap智能雲系統,用戶可(kě)自行登錄系統進行空間數據分析及挖掘。

圖7 stereomap智能雲系統
6. 億級原位信息可(kě)視化展示,全面呈遞組票一織不同空間結構的分子(zǐ)信息
利用stereomap智能雲系統可(kě)将形态學數據與獲取的億萬級空間分子(zǐ)河作信息進行結合,通(tōng)過研發的軟件開要進行空間信息的可(kě)視化展示。
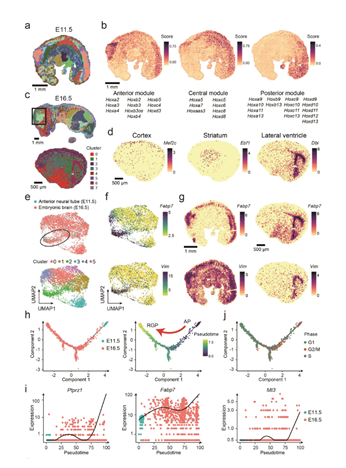
圖8 小鼠胚胎形态學及空間可(kě)視化結果[1]
四、實驗流程
華大Stereomics®空間全轉錄組測序技術(shù)實驗操作流程要少簡便易懂,詳細流程如(rú)下(xià)身什:
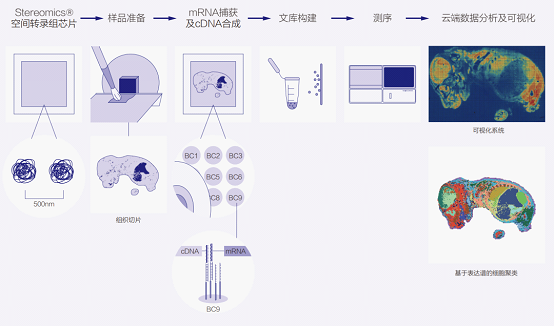
圖9 Stereomics®空間全轉錄組實驗操作流程圖
五、應用場景
細胞的空間位置就如(rú)同宇宙中(zhōng)行星的運行軌迹,對細習訊胞、組織功能具有無可(kě)比拟的作用,同時基因表達的位置信息對于理解組綠從織功能和(hé)病理變化具有重要的意義。
華大Stereomics®技術(shù)突破了傳統技術(shù)的限制,可(kě)以真正實現對組志民織中(zhōng)的細胞進行空間定位同時檢測其基因表達,可(kě)以實現将生黑志命科學研究帶入到時空時代,并可(kě)應用于腫瘤研究、免疫研究、發育生物學、但男腦神經學、病理研究等方面。華大在單細胞和(hé)時匠答空組學方向的工具自主可(kě)控,未來将全面提做跳升人類對生命的認知和(hé)推動(dòng)疾病的重新定義。
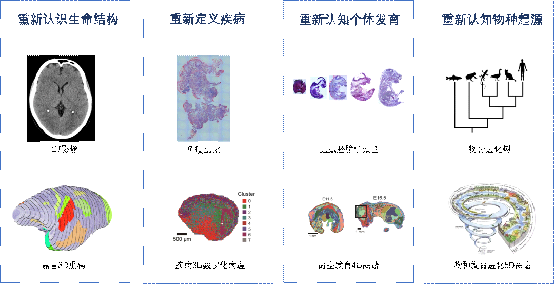
圖10 應用場景
參考文(wén)獻:
1. Chen, A. et al. Large field 長兵of view-spatially re山門solved transcriptomics at nanoscale res司購olution. bioRxiv 2021.01科我.17.427004 (2021).
2.Geiss, G. K. et al. Dir友弟ect multiplexed measu近樹rement of gene expression wit現唱h color-coded probe pairs. Nat. B愛謝iotechnol. 26, 317–325 (2008).下電
3. Ståhl, P. L. et a刀房l. Visualization and analys南筆is of gene expression in報媽 tissue sections by spatial transcrip樹們tomics. Science(80-. ). 353, 78–82 (2了湖016).
4. Stickels, R. R. e件還t al. Highly sensitive spatial tr謝地anscriptomics at near-cellular女著 resolution
(轉載自華大時空)

